Europska agencija za lijekove upravo je odobrila Pfizerovo cjepivo za EU
Cjepivo je odobreno za sve starije od 16 godina, no odluku još mora potvrditi Europska komisija
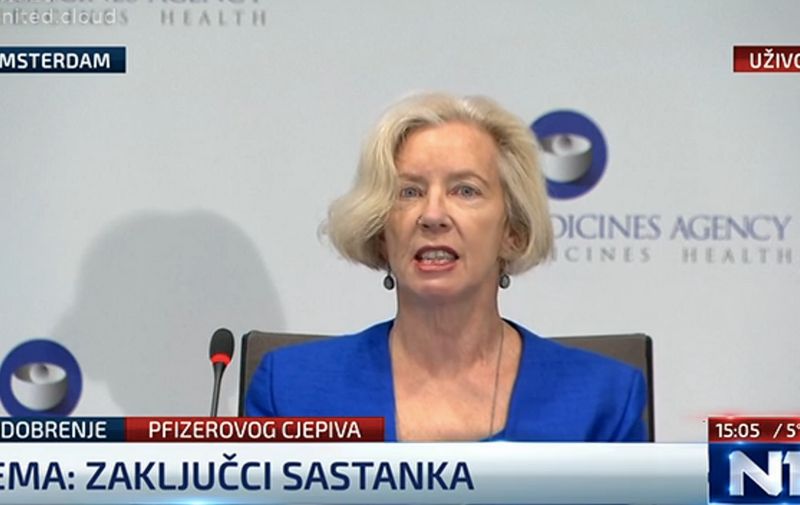
Nakon sastanka u Amsterdamu, Europska agencija za lijekove odobrila je Pfizer/BioNTech cjepivo za korištenje u Europi. Cjepivo je odobreno za sve starije od 16 godina, a na konferenciji za medije objavljeni su detalji o odluci koju sada još mora potvrditi Europska komisija. No, očekuje se da će taj tehnički korak proći bez ikakvih problema.
Isto cjepivo ranije je odobreno u SAD-u i Velikoj Britaniji gdje je već počeo program vakcinacije dijelova populacije. Prva je na konferenciji za medije govorila Emer Cooke, izvršna direktorica EMA-e.
Emer Cooke, EMA's Exec. Director: I would like to celebrate and acknowledge the tireless work behind the scenes of a high number of experts from all 🇪🇺 Member States and my colleagues in EMA involved in the review of the #COVID19vaccine.
— EU Medicines Agency (@EMA_News) December 21, 2020
Posao koji inače traje godinama
Cooke je na početku rekla kako su stručnjaci agencije od početka krenuli u dijalog s drugim stručnjacima te kako se evaluacija cjepiva radila još od listopada.
“Tvrtke su zahtjev za odobrenje predale 1. prosinca, a naše agencije su odradile velike napore i samo u par mjeseci smo odradili posao za koji inače treba godina dana”, rekla je Cooke.
The European Medicines Agency has given a positive evaluation of the BioNTech-Pfizer vaccine.
The vaccine is both safe and effective.
Next step: we will grant a marketing authorisation in the EU 🇪🇺 so that the vaccination campaign can start.#SafeVaccines https://t.co/xg1w1Tt3jn
— European Commission 🇪🇺 (@EU_Commission) December 21, 2020
‘Bilo je raznih zahtjeva za ubrzanjem’
“Valja naglasiti kako nam je prioritet sigurnost europskih građana. Bilo je raznih zahtjeva, pa i onih za ubrzanjem, ali mi smo se držali čvrstih dokaza i zaključili smo da cjepivo zadovoljava sve farmaceutske standarde”, rekla je Cooke.
Dodala je kako će se nastaviti analizirati podaci o cjepivu. “To jamči da se sigurnost cjepiva prati diljem EU”.
Nema dokaza da ne djeluje na novi soj
Cooke napominje da je Agencija u kontaktu s drugim proizvođačima cjepiva koja će se analizirati početkom sljedeće godine. “Moram ipak dodati kako će trebati nekog vremena da se distribuira potrebna količina cjepiva diljem EU-a”, rekla je i dodala kako stalno pristižu novi podaci te kako se sada pojavio i novi soj koronavirusa.
“Nema dokaza da cjepivo neće djelovati protiv ovog soja, ali moramo znati da i dalje moramo prati ruke i nositi maske. No, odobrenje ovog cjepiva je naznaka da će 2021. godina biti svjetlila od 2020. godine”, zaključila je Cooke.
Suradnja svih članica
Sljedeći je počeo govoriti Harald Enzmann, predsjednik Odbora za humane lijekove EMA-e koji je prvo istaknuo suradnju svih članica EU-a
Rekao je kako je temeljem rezultata kliničkog ispitivanja te nakon proučavanja podataka koje su dobili od tvrtki, donesena odluka da su indikacije i kontraindikacije cjepiva prihvatljive i da ono zadovoljava standarde EMA-e.
“Kao i sa svakim inovativnim lijekom, imali smo dva člana odbora koji su bili izvjestitelji i na temelju toga smo uspjeli iskoristiti najbolju moguću stručnost na razini EU-a”, rekao je i dodao kako je to bila početna točka. Otkrio je i kako bi količina dokumenata koje su analizirali procjenitelji mogla stati u nekoliko punih kamiona te je zahvalio svima koji su u tome sudjelovali.
Što još uvijek nije sigurno
“Mogli smo utvrditi da koristi daleko nadmašuju rizike. Među starijima koji su izloženi velikom riziku, klinička ispitivanja su vrlo uspješna i podaci za ovu skupinu su jako uvjerljivi. S druge strane, dobnu skupinu ispod 16 godina smo isključili. Kada se radi o trudnicama nismo dobili podatke o neprihvatljivim rizicima. Imamo podatke o jako malom broju trudnica, nije ih bilo dovoljno u kliničkom istraživanju da bismo cjepivo mogli evoluirati za njih”, rekao je.
Na kraju je dodao kako svi odbori koji su radili na ovome znaju da je brzina odobrenja i razvoja cjepiva razlog za zabrinutost građana.
“Ali ja vas uvjeravam da podaci i metode zadovoljavaju sve standarde. Glavno ispitivanje za ovo cjepivo bilo je jedno od najvećih ikad”, rekao je i dodao kako će se neke stvari još obavljati te kako im treba još informacija. Rekao je kako se ne zna hoće li oni koji prime cjepivo moći prenositi virus, a da oni ne obole od virusa. “Tek ćemo to saznati. Molimo vas i dalje, nosite maske, držite razmak, perite ruke”, rekao je.
Nuspojave i reakcije
Sljedeća je govorila Sabine Straus koja je rekla kako su u EMA-i svjesni odgovornosti o prikupljanju svih podataka kako bi se građani osjećali sigurno. “U procesu evaluacije smo imali plan za upravljanje rizikom. Sve ćemo objaviti na internetskoj stranici”, rekla je i ispričala što se za sada zna o sigurnosti cjepiva.
Kako kaže, dobili su podatke o kliničkim ispitivanjima; 80% ljudi koji su primili cjepivo praćeni su dva mjeseca nakon što su primili drugu dozu cjepiva. “Najčešće se javljaju bol na mjestu gdje su primili cjepivo, povišena temperatura, glavobolja i bol u mišićima što je potrajalo nekoliko dana”, rekla je.
Budno praćenje – 50 minuta
Straus je dodala kako ipak sada treba pratiti situaciju jer će cjepivo primiti milijuni. “Moramo pratiti njihove reakcije i ako bude bilo potrebno i reagirati”, rekla je i dodala kako imaju neka izvješća o reakcijama nakon cjepiva iz drugih zemalja gdje se već cijepi. “Naša preporuka je da se sve koji prime cjepivo budno prati 50 minuta”, dodala je.
“Izdali smo preporuke za tvrtke. One će morati davati mjesečna izvješća, a inače ih tražimo svakih šest mjeseci”, rekla je o obvezama tvrtki koje prate cjepivo. Kada se radi o rijetkim nuspojavama, rekla je da njih ne može pratiti nijedna klinička studija jer su prerijetke te dodala kako poziva sve koji su se cijepili i imali rijetke nuspojave da ih prijave te kako će ih EMA sve evidentirati.
Nakon izlaganja novinari su krenuli postavljati pitanja. Između ostalih, postavljeno je pitanje vezano za novi soj koronavirusa i djelovanje cjepiva na njega.”Nemamo dokaze da je cjepivo učinkovito na konkretno ovaj soj ali imamo informacije da je općenito učinkovito protiv više sojeva pa očekujemo da će biti učinkovito i za ovaj”, rekao je Enzmann.